- Trombosis y Coagulación Hemorrágica en el COVID-19: Un Análisis Neutral e Informativo
- ,
- Trombosis y Coagulación Hemorrágica en el COVID-19: Un Análisis Neutral e Informativo
- Preguntas frecuentes
- FAQs sobre Trombosis y Coagulación Hemorrágica en COVID-19: Un Análisis Neutral e Informativo
- Conclusiones sobre Trombosis y Coagulación Hemorrágica en COVID-10: Un Análisis Neutral e Informativo
- Recursos Adicionales sobre Trombosis y Coagulación Hemorrágica en COVID-19
- Conclusión Final
- Texto original (2020)
- ¿Por qué se produce la trombosis?
- ¿Cómo se combate la formación de trombos?
Nota editorial (2025): publicado originalmente en 2020. Se añadió una versión estructurada con fines enciclopédicos. El texto original se conserva íntegro como parte del archivo histórico.
Trombosis y Coagulación Hemorrágica en el COVID-19: Un Análisis Neutral e Informativo
Editorial del Artículo:
Devuelve el resultado EXCLUSIVAMENTE en HTML válido. Usa SOLO estas etiquetas:
,
. NO uses Markdown, # ni ##. No encierres el texto en bloques de código.
Trombosis y Coagulación Hemorrágica en el COVID-19: Un Análisis Neutral e Informativo
Este artículo examina los efectos de la COVID-19, una enfermedad respiratoria viral aguda causada por SARS-CoV-2, en la patología trombótica observada en pacientes infectados.
Introducción
La COVID-19 es una enfermedad respiratoria global cuyos síntomas, junto con los efectos sistémicos en el organismo infectado, incluyen la trombosis. Este artículo explora cómo se desarrolla este fenómeno y sus implicancias para la gestión del COVID-19.
Trombosis en pacientes con COVID-19
La coagulación sanguínea es una respuesta natural al sangrado, pero a veces puede volverse patológica. La trombosis observada en pacientes infectados por el SARS-CoV-2 resulta de un desequilibrio entre la coagulación y su regulación.
Coagulación y Endotelitis Vascular en COVID-19:**
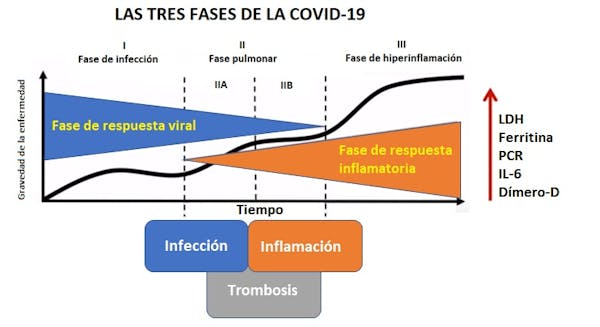
El SARS-CoV-2 infecta principalmente las células epiteliales respiratorias pero también tiene un tropismo por los endotelios vasculares, lo que puede causar una inflamación conocida como endotelitis. Esta reacción se traduce en aumento de la formación de trombos (Figura 2).
Strategias Antitrombóticas y la Aspirina**
La presencia de trombosis sistémica en pacientes con COVID-19 ha llevado a considerar estrategias terapéuticas antitrombóticas, especialmente las heparinas. La aspirina también se utiliza para reducir el riesgo hemorrágico asociado con la trombosis.
Preguntas frecuentes
«`html
FAQs sobre Trombosis y Coagulación Hemorrágica en COVID-19: Un Análisis Neutral e Informativo
¿Qué efectos sistémicos puede tener la COVID-19 más allá de los síntomas respiratorios?**Respuesta: Al igual que otros virus, SARS-CoV-2 también causa una respuesta inflamatoria y coagulacional elevada en el cuerpo.
¿Cómo se relaciona la COVID-19 con la trombosis?**Respuesta: La infección por SARS-CoV-2 puede resultar en un desequilibrio entre la coagulación sanguínea y su regulación, provocando una formación excesiva de trombos.
¿Qué implica el endotelitis vascular para pacientes con COVID-19?**Respuesta: La inflamación del endotelio conocido como endotelitis puede incrementar la formación de trombos y contribuir a los efectos sistémicos asociados.
¿Se utilizan estrategias terapéuticas antitrombóticas para pacientes con COVID-19?**Respuesta: Sí, se están considerando estrategias antitrombóticas como las heparinas y la aspirina debido a la presencia de trombosis sistémica en algunos casos.
¿Cómo se compara el riesgo hemorrágico asociado con la trombosis frente al uso de medicamentos antitromboticos?**Respuesta: Aunque las estrategias terapéuticas antitrombóticas pueden ser útiles para prevenir más daños, se debe tener en cuenta que puede aumentar el riesgo hemorrágico y siempre es importante consultar con un médico.
¿Cómo debería uno manejar su salud si tiene trombosis debido a COVID-19?**Respuesta: Es fundamental seguir las recomendaciones del equipo médico, tomar los medicamentos prescritos y mantener una comunicación constante con ellos para optimizar la gestión de la enfermedad.
Conclusiones sobre Trombosis y Coagulación Hemorrágica en COVID-10: Un Análisis Neutral e Informativo
¿Qué desafíos presenta el tratamiento de la trombosis hemorrágica asociada con la COVID-19?** Respuesta: El uso terapéutico antitrombótico debe equilibrarse cuidadosamente para prevenir más daños y manejar los riesgos hemorrágicos.
¿Cuál es el papel de la aspirina en pacientes con COVID-19 que presentan trombosis?** Respuesta: La aspirina puede tener un efecto antitrombótico beneficioso, pero su uso debe ser cuidadosamente supervisado por profesionales médicos.
¿Cómo se pueden prevenir o manejar mejor las complicaciones trombóticas en pacientes COVID-19?** Respuesta: Es clave comprender los efectos sistémicos y trabajar con un equipo de atención médica para optimizar la gestión.
Recursos Adicionales sobre Trombosis y Coagulación Hemorrágica en COVID-19
Referencias:** Respuesta: Para obtener información más profunda, se puede buscar estudios como los de Varga et al. (2020) que investigan la presencia y regulación del endotelio en pacientes infectados.
Sitios web recomendados:** Respuesta: Sistemas como el Informe Mundial COVID-19 proporcionan datos actualizados e información de calidad sobre la situación global de la enfermedad y sus efectos sistémicos, incluyendo trombosis.
Conclusión Final
¿Cómo contribuye esta revisión al entendimiento del COVID-19 en relación con el endotelitis vascular y la coagulación?** Respuesta: Esta revisión proporciona un análisis informativo que desmiente información errónea sobre medicamentos como la aspirina, mientras también enfatiza su eficacia antitrombótica en ciertos contextos. La comprensión de estos aspectos es crucial para una mejor gestión del COVID-19 y los efectos sistémicos asociados.
«`
Texto original (2020)
Este artículo examina el papel desconcertante que los trombos jugaron en la afectación del secretario general de Vox, Javier Ortega Smith. A pesar de ser un fenomeno comunicado desde antes incluso de las primeras noticias sobre COVID-19, es misterioso por su conexión al desarrollo enfermizo y la muerte del infectado. Se explora cómo este patrón no se limita a los pulmones afectados directamente por el virus sino que también llega hasta otros sistemas vitales, incrementando significativamente su riesgo de vida al formar trombos en distintas partes del cuerpo. Además, nos adentraremos en las implicaciones para la gestión y tratamiento del COVID-19 relacionadas con estas alteraciones hemorrágicas anormales que se presentan tanto como complicación primaria de la enfermedad, así como un indicador prognóstico. El artículo también aborda las teorías erroneas publicadas en medios de comunicación social sobre el uso de aspirina y heparinas para combatir la formación de trombos durante COVID-19, ofreciendo correcciones basadas en investigaciones científelticas pertinentes.
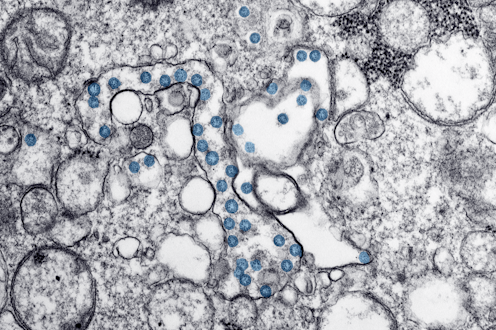
El ingreso en un hospital del secretario general de Vox, Javier Ortega Smith, ha sembrado desconcierto sobre la aparición de trombos, una manifestación sintomática de la COVID-19 que no es misteriosa en absoluto, aunque sí pueda ser preocupante. La coagulación de la sangre es un mecanismo de defensa orgánica que surgió hace unos 430 millones de años. Este mecanismo ha representado una ventaja evolutiva en vertebrados.
Los humanos, como el resto de los vertebrados, estamos expuestos a las hemorragias y les hacemos frente gracias a la trombogénesis. Los primeros humanos estaban constantemente en peligro de desangrarse tras sufrir terribles heridas en la caza o en la guerra. Somos los descendientes de aquellos ancestros y por eso somos trombogénicos por naturaleza.
Pero en el antagonismo hemorragia versus trombogénesis se produce un típico caso de paradoja pleiotrópica: a edades avanzadas morimos muchas más veces de trombosis que de hemorragia. La formación de trombos, que nos ha salvado tantas veces la vida conteniendo las hemorragias, pasa factura en las enfermedades que cursan con anomalías endoteliales, entre ellas la COVID-19.
Semanas atrás aparecieron noticias alarmistas que ponían el acento en la “misteriosa” proliferación de trombos que estaba matando a los infectados por coronavirus en los que provocaba infartos cerebrales y de corazón, además de lesiones isquémicas cutáneas. Como no podía ser menos en los tiempos que corren, las redes generaron un bulo desmentido por Newtral.
Siddiqi & Mehra
En los casos de COVID-19 no hay misterio alguno en la formación de coágulos de sangre dentro de vasos de pequeño calibre. Desde el principio de la pandemia los científicos chinos detectaron este hecho. El 31 de enero patólogos de hospitales de Wuhan ya habían comenzado a realizar autopsias, cuyos resultados fueron recogidos el 9 de marzo en la revista The Lancet.
El artículo, que analiza información de 191 pacientes chinos, 54 de ellos fallecidos durante el mes de enero, documentaba la alteración de la coagulación que conducía a la formación de trombos en los enfermos más graves, un síntoma que las autoridades chinas ya habían incluido en el manual de gestión de la enfermedad publicado el 18 de febrero.
Otros estudios publicados con posterioridad realizados con pacientes holandeses, italianos y estadounidenses confirmaron lo que los médicos de todo el mundo ya sospechaban: uno de los marcadores de mal pronóstico en la COVID-19 eran los análisis que detectaban la formación de trombos (Figura 1).
Por eso los pacientes fueron tratados sistemáticamente con heparinas de bajo peso molecular, unos anticoagulantes muy empleados en todo tipo situaciones con riesgo de formación de trombos.
¿Por qué se produce la trombosis?
La COVID-19 es una enfermedad cuyas dianas son los epitelios glandulares de las vías respiratoria y digestiva, pero el virus también tiene tropismo por los endotelios. Es una infección vírica asociada a una repuesta inflamatoria sistémica, a una neumonía intersticial aguda y a la activación de la coagulación tanto a nivel pulmonar, como en el resto de los órganos.
La sangre es un tejido líquido en equilibrio inestable, que cuando está fuera de nuestro cuerpo coagula. También coagula dentro, cuando se estanca la circulación en venas varicosas (trombosis), o cuando las venas se inflaman (tromboflebitis). Cuando la sangre está en circulación, la coagulación es mínima y está neutralizada por el sistema fibrinolítico.
Los coágulos o trombos reciben su nombre de la trombina, una enzima que convierte el fibrinógeno en fibrina. El fibrinógeno es una proteína soluble del plasma sanguíneo que actúa como precursor de la fibrina, una proteína fibrilar que precipita formando una red en la que quedan atrapados los elementos de la sangre formando coágulos y trombos. Cuando se produce una herida, la respuesta adrenérgica y el daño vascular (lesión endotelial) liberan trombina y otras moléculas que desencadenan una cascada de factores de la coagulación: crece el trombo de fibrina y esta actúa como una especie de pegamento taponando las heridas.
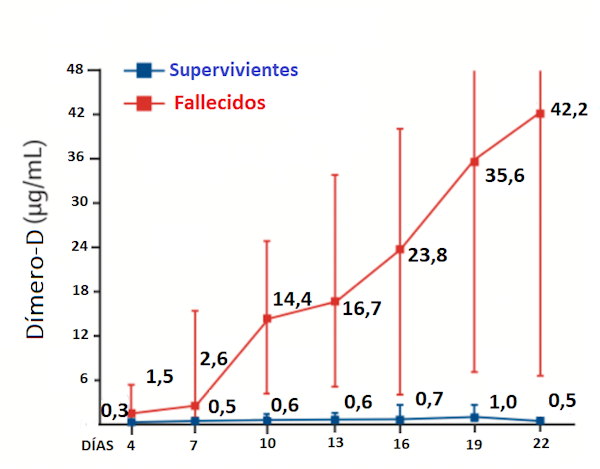
A su vez, la fibrina es degradada por otro sistema de defensa, el sistema fibrinolítico, con formación de una molécula marcadora de dicha actividad: el dímero-D. La presencia en las analíticas a determinadas concentraciones de dímero D es indicadora de la existencia de niveles anormales de fibrina y, por tanto, de trombosis, es decir, de la formación de coágulos sanguíneos en arterias o venas.
Zhou et al. 2020.
Los investigadores chinos ya habían publicado el 9 de marzo la relación entre el dímero-D y la gravedad de la COVID-19. En la Figura 2 puede comprobarse cómo, a medida que transcurren los días, en los pacientes que van a fallecer va aumentando el riesgo de formación de trombos, cuyo indicador es el incremento en los niveles de dímero-D.
Tanto las células epiteliales respiratorias y digestivas, como las células endoteliales que tapizan toda la superficie interna de los vasos sanguíneos, tienen unas cerraduras (receptores) que abre el SARS-CoV-2. La llave del virus es una proteína espiculada de su cápsula. El virus entra al cuerpo a través de la nariz, la boca o los ojos y después se aferra a las células epiteliales y endoteliales que presentan en su membrana externa numerosos receptores ACE2.
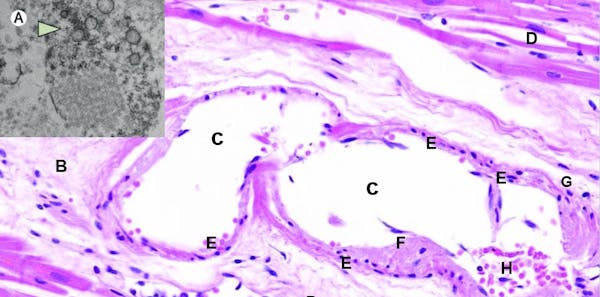
Varga et al. 2020
Tanto las células epiteliales de los alvéolos pulmonares (neumocitos) como los endotelios vasculares disponen de receptores ACE2 en abundancia. Este receptor es la cerradura que encaja a la perfección con la proteína espiculada del virus, de forma que estas células abren sus puertas de par en par a la entrada del coronavirus, lo que provoca una endotelitis, es decir, una inflamación del endotelio vascular (Figura 3).
¿Cómo se combate la formación de trombos?
El hecho de que se presente coagulopatía en los pacientes con COVID-19 ha promovido que se planteen estrategias antitrombóticas, sobre todo en los pacientes que ingresan en la UCI y muestran daño orgánico o episodios isquémicos. Si bien aún no se ha establecido la mejor estrategia antitrombótica, parece que las heparinas de bajo peso molecular a dosis profilácticas o intermedias están indicadas cuando los valores de dímero-D sean superiores a los normales. La anticoagulación terapéutica se reserva para los casos en los que se ve una clara patología trombótica local o sistémica.
En cuanto al uso de la aspirina que propugnan algunas redes sociales, remitimos a este contundente y esclarecedor artículo. La aspirina como antiagregante disminuye el riesgo trombótico de ateromas, pero no sirve ni siquiera para amortiguar los trombos causados en el síndrome de la clase turista o trombosis del viajero.
![]()
Manuel Peinado Lorca es responsable del Grupo Federal de Biodiversidad del PSOE
José Miguel Sanz Anquela no recibe salario, ni ejerce labores de consultoría, ni posee acciones, ni recibe financiación de ninguna compañía u organización que pueda obtener beneficio de este artículo, y ha declarado carecer de vínculos relevantes más allá del cargo académico citado.
Fuente: The Conversation (Creative Commons)
Author: Manuel Peinado Lorca, Catedrático de Universidad. Departamento de Ciencias de la Vida e Investigador del Instituto Franklin de Estudios Norteamericanos, Universidad de Alcalá
