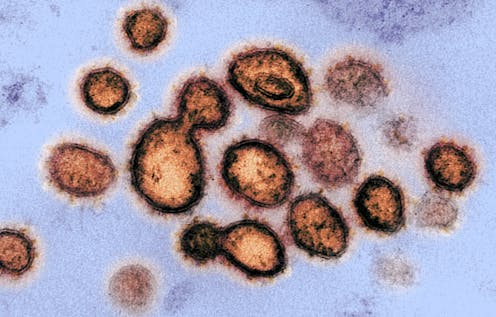
En el coronavirus SARS-CoV-2, como en todos los virus, la flexibilidad y la plasticidad estructurales tienen una especial relevancia. La manera en que el SARS-CoV-2 infecta nuestras células se explica analizando su estructura molecular y, sobre todo, fijándonos en las regiones dúctiles de las proteínas que lo forman.
El material genético de los virus, en este caso el ARN, se encuentra empaquetado con miles de pequeñas subunidades de nucleoproteínas en el interior de una envuelta de lípidos llamada cápside que, en el caso de los coronavirus, tiene forma de corona. El tamaño del genoma de los coronavirus es mayor que el de otros virus tipo ARN. El genoma del SARS-CoV-2 codifica catorce proteínas funcionales.
En la cápside se localizan la proteína S (Spike –espiga– en inglés), la proteína E (de la Envuelta) y la proteína M (de la Membrana), que cumplen con la función estructural de ensamblar el virus y de reconocer la célula huésped. En el interior de la cápside, se encuentra la nucleoproteína N, que interacciona con el ARN viral proporcionándole estabilidad. A estas proteínas se suman otras diez estructurales de menor tamaño y dieciséis más no estructurales que participan en la replicación y la transcripción del virus en la célula huésped.
Al conjunto de proteínas accesorias y no estructurales se le ha denominado, un tanto literariamente, proteoma oscuro del SARS-CoV-2. Aunque menos estudiado, encierra elementos importantes para la biología del virus y su infectividad, como veremos enseguida. Otra característica a destacar de los virus tipo SARS es que todas sus proteínas tienen tendencia a unirse al material genético.
La estructura del SARS-CoV-2
Desde que comenzó la pandemia, la explosión de trabajos científicos en torno al SARS-CoV-2 ha proporcionado rápidamente numerosos resultados sobre la estructura de sus proteínas, muchos de ellos inspirados en el conocimiento que se tenía de otros virus emparentados: el SARS-CoV (conocido desde 2002) y el MERS-CoV (conocido en 2012).
Desde mediados del siglo XX, el estudio de la estructura de las proteínas se ha abordado mediante técnicas biofísicas fundamentadas en la interacción de la radiación electromagnética con la materia, por ejemplo, las técnicas espectroscópicas, que abarcan un rango de posibilidades tan amplio como el del espectro electromagnético. Pero el éxito de los estudios con cristalografía y difracción de rayos X ha llevado a colocar esta técnica en el primer puesto del ranking para resolver la estructura tridimensional de estas biomoléculas a nivel atómico e inferir su función. Una prueba de ello es que, a día de hoy, se contabilizan cerca de cuatrocientas estructuras del SARS-CoV-2 resueltas con esta técnica en 2020, según los datos del Protein Data Bank –el repositorio que registra las estructuras tridimensionales conocidas de las proteínas y los ácidos nucleicos–.
Las estructuras resueltas por otras técnicas clásicas, como la resonancia magnética nuclear (RMN) o como la difracción de neutrones, son minoritarias y no llegan a alcanzar la decena. El extraordinario esfuerzo de la comunidad científica en este campo durante el último año se pone de manifiesto cuando contamos que, en el periodo 2002-2019, las estructuras resueltas de los virus tipo SARS eran cerca de la mitad.
La proteína S del SARS-CoV-2 es, con diferencia, la más estudiada por cristalografía de rayos X. Se cuentan hasta ciento treinta y siete estructuras tridimensionales resueltas. La extraordinaria atención que ha tenido se debe a que es clave para la infección pues funciona como la llave de entrada del virus en la célula huésped al acoplarse a la proteína receptora ACE2 que actúa como cerradura en la mucosa oral, principal vía de entrada en el cuerpo humano. Es, por tanto, determinante en la fusión de la membrana viral con la célula huésped al permitir la liberación del genoma del virus y causar la infección.
La nucleoproteína N le sigue con trece estructuras resueltas hasta ahora y participa en el proceso intracelular de replicación y transcripción del genoma del virus.
La resolución de las estructuras del ‘proteoma oscuro del SARS-CoV-2’ es escasa, en parte debido a la dificultad de encontrar proteínas homólogas disponibles en otros virus o de resolver sus regiones dúctiles. Como alternativa, las técnicas de microscopía están contribuyendo al conocimiento de su papel, seguramente relevante, en la biología del virus.
Las regiones dúctiles de las proteínas influyen en la infectividad
Algunos elementos estructurales de las proteínas escapan de los procedimientos experimentales de la cristalografía y difracción de rayos X. Pero no por ello dejan de ser importantes, al contrario, a menudo resultan cruciales para su funcionamiento. Esa falta de estructura es una característica útil.
Las regiones dúctiles (IDRs) son biológicamente activas y altamente dinámicas en el reconocimiento molecular, en la unión con otras biomoléculas o átomos (ADN, ARN, proteínas, azúcares, metales) y en el ensamblaje de los complejos moleculares. Pueden adoptar rápidamente conformaciones interconvertibles bajo diferentes condiciones fisiológicas. Así, los elementos estructurados y los flexibles se complementan.
Las proteínas virales contienen un gran número de regiones dúctiles y diversos estudios correlacionan esta característica con la virulencia. En SARS-CoV-2, como en todos los virus, las regiones dúctiles establecen interacciones con otras proteínas y con el material genético. Por ejemplo, en la nucleoproteína N, su alta proporción de regiones flexibles posibilita una estrecha interacción con el ARN viral y con otras proteínas de la membrana, como la glucoproteína M, que es la más abundante en el virus, o con las proteínas de la célula huésped, siendo así multifuncional.
El resto de proteínas del SARS-CoV-2, incluida la proteína S, tienen un moderado o bajo contenido en regiones dúctiles, pero algunas de ellas pueden ser cruciales para modular la infección. En un reciente trabajo publicado en Nature se han encontrado hasta trescientas treinta y dos interacciones entre las proteínas del SARS-CoV-2 y proteínas humanas. La mayoría de ellas tienen como protagonista a la proteína S y las proteínas accesorias no estructurales Nsp7 y Nsp8 del virus. La flexibilidad y movimiento de las proteínas S en la envuelta de la cápside (se cuentan hasta cerca de cuarenta unidades) es determinante para el reconocimiento de las membranas celulares y su unión a ellas. En varios trabajos, con ayuda de la criomicroscopía electrónica de alta resolución, se ha probado que existe una flexibilidad continua y característica en la proteína S, que es lo que hace que este virus sea diferente a otros coronavirus.
Como se ha sugerido, las regiones dúctiles del ‘proteoma oscuro del SARS-CoV-2’ también son relevantes. Las herramientas computacionales e informáticas proporcionan una valiosa información sobre si una proteína adopta, o no, una estructura tridimensional bien definida, y si una región flexible está, o no, implicada en el reconocimiento molecular. El reciente estudio publicado en Cellular and Molecular Life Sciences concluye que casi todas las proteínas del SARS-CoV-2 tienen uno o más segmentos de reconocimiento molecular. El aumento de la flexibilidad en regiones concretas de las proteínas correlaciona con la infectividad. En algunos casos, las predicciones asociadas a esas correlaciones llegan a ser probadas.
Un reciente trabajo publicado en Nature muestra evidencia clínica de que la mutación D614G en la proteína S del SARS-CoV-2, detectada en una variante surgida en Europa durante el mes de enero, aumenta la replicación en las células epiteliales del pulmón y en los tejidos primarios de las vías respiratoria, con lo que se potencia la infectividad. Esa mutación –una sustitución de aspartato por glicina– supone una pérdida de complejidad en la secuencia y una ganancia de flexibilidad local. Un fuerte cambio fenotípico relacionado con la virulencia y asociado a una mutación por glicina también se ha descrito en la bacteria Mycobacterium tuberculosis.
La relación entre ductilidad e infectividad está siendo útil en el diseño de nuevas terapias dirigidas a bloquear la entrada del virus en la célula o su replicación. Algunos de los diseños de las vacunas y fármacos antivirales intentan bloquear sitios específicos de las proteínas inspirados en este conocimiento para impedir la infección. Es una puerta abierta a la esperanza.
![]()
Inmaculada Yruela Guerrero no recibe financiación de ninguna compañía u organización que pueda obtener beneficio de este artículo.
Fuente: The Conversation (Creative Commons)
Author: Inmaculada Yruela Guerrero, Investigadora Científica CSIC, Estación Experimental de Aula Dei (EEAD – CSIC)
